
Nouveaux hypolipémiants
En prévention cardiovasculaire de l’athérosclérose et en dépit du bénéfice démontré d’un traitement par statine seule ou associée à l’ézétimibe, le risque cardiovasculaire résiduel lié à un excès de lipoprotéines athérogènes reste élevé pour un grand nombre de patients en raison soit d’un taux de LDL-cholestérol (LDL-C) mal contrôlé, soit d’un excès de lipoprotéines riches en triglycérides (TG), soit enfin d’une élévation de la lipoprotéine(a) (Lp(a)). Les anticorps monoclonaux dirigés contre PCSK9 (alirocumab et évolocumab) sont déjà disponibles, mais de nombreuses nouvelles approches thérapeutiques sont en développement ou en cours d’enregistrement, approches indiquées dans la table et la figure.
Nouveaux traitements pour réduire le LDL-C
Nouveaux inhibiteurs de PCSK9
Les anticorps monoclonaux, alirocumab et évolocumab, bloquent PCSK9 dans le plasma et la même stratégie d’inhibition extracellulaire est possible avec une adnectine qui se lie à PCSK9 circulant. Le lerodalcibep (ou LIB003) montre en phase 2 une efficacité biologique au moins comparable à celle des anticorps monoclonaux.
Une autre approche pour inhiber PCSK9 est d’agir en intracellulaire sur la production de la protéine. Inclisiran est un ARN interférent synthétique dirigé contre l’ARN messager de PCSK9, avec une modification chimique qui induit une liaison rapide et spécifique au niveau hépatique permettant de réduire la dose administrée et les effets secondaires potentiels. La stratégie utilisée en phase 3 (une injection sous-cutanée (SC) de 300 mg initiale, puis à 3 mois et ensuite tous les 6 mois) permet d’obtenir une réduction moyenne de LDL-C au long cours d’environ 50% avec un recul d’au moins 18 mois en termes d’efficacité et une tolérance comparable au placebo, en dehors de réactions au site d’injection plus fréquentes mais modérées1 .
L’essai de prévention cardiovasculaire ORION-4 en cours permettra de déterminer le bénéfice cardiovasculaire et la tolérance à long terme chez des patients avec maladie cardiovasculaire athéromateuse stabilisée.
Enfin, plusieurs inhibiteurs oraux de PCSK9 et un oligonucléotide antisens (AZD8233) sont également en développement.
Acide bempédoïque
L’acide bempédoïque inhibe l’enzyme adénosine triphosphate-citrate lyase (ACL) qui régule la biosynthèse du cholestérol en amont de l’HMG-CoA réductase. Des études génétiques suggèrent qu’une activité basse en ACL est associée à des effets favorables sur les paramètres lipidiques et le risque cardiovasculaire similaires à ceux observés en cas de diminution de l’activité de l’HMG-CoA réductase. L’acide bempédoïque est une prodrogue : la forme active est produite au niveau du foie mais pas dans les muscles, suggérant une meilleure tolérance musculaire par rapport aux statines. A la dose de 180 mg par jour, l’acide bempédoïque réduit le LDL-C d’environ 24% en monothérapie et 18% chez des patients sous statines à la dose maximale tolérée2 .
L’acide bempédoïque seul et en association fixe avec l’ézétimibe a été approuvé par l’European Medicine Agency (EMA) en janvier 2020 pour le traitement des hypercholestérolémies primaires et des dyslipidémies mixtes. Un essai de prévention cardiovasculaire CLEAR-Outcomes est en cours chez des patients intolérants aux statines.
Evinacumab
L’évinacumab est un anticorps monoclonal humain qui bloque la protéine angiopoëtinelike 3 (ANGPTL3). Cette protéine exprimée essentiellement au niveau hépatique inhibe la lipoprotéine lipase (LPL) et la lipase endothéliale et de ce fait, réduit la conversion des VLDL en LDL. Evinacumab s’est avéré particulièrement efficace dans l’hypercholestérolémie familiale homozygote même chez des patients ayant une activité nulle en LDL-récepteurs3 . Evinacumab est également efficace chez des patients avec hypercholestérolémie réfractaire aux traitements usuels. La tolérance dans les essais publiés est comparable au placebo. Ce dérivé doit prochainement être disponible pour les formes très sévères d’hypercholestérolémie familiale homozygote.
Nouveaux traitements pour réduire les lipoprotéines riches en triglycérides (TG)
Acides gras Ω3
Une supplémentation d’acides gras Ω3 de 1 g/ jour n’est pas associée à une réduction du risque d’événements cardiovasculaires majeurs. Les acides gras Ω3 EPA (acide écosapentaénoïque) et DHA (acide docosahexaénoïque) ont un effet hypotriglycéridémiant significatif lorsqu’ils sont utilisés à des doses de 4 g/jour, doses testées dans 2 essais de prévention cardiovasculaire :
Dans l’étude REDUCE-IT, l’EPA purifi é ou icosapent éthyl (IPE) à la dose de 4 g/jour chez des patients soit en prévention secondaire, soit avec diabète et au moins un autre facteur de risque, traités par statine et avec TG élevés, a réduit significativement de 25% les évènements cardiovasculaires majeurs4 . Le bénéfice cardiovasculaire ne paraît pas lié uniquement à la réduction des TG, avec en parallèle d’autres effets bénéfiques en particulier anti-inflammatoires.
Dans l’étude STRENGHT, un mélange d’EPA et de DHA, utilisé également à la dose de 4 g/jour, n’a pas montré de bénéfice cardiovasculaire chez des patients traités par statine et avec TG élevés. Par comparaison à l’étude REDUCE-IT, les taux d’EPA plasmatiques et dans les globules rouges étaient toutefois plus bas, mais il n’est pas certain que cette différence permette d’expliquer l’impact sur le pronostic cardiovasculaire.
L’EPA purifi é (IPE) a été approuvé par l’EMA dans l’indication « Réduction des évènements cardiovasculaires chez des adultes traités par statine à haut risque cardiovasculaire, avec TG élevés (≥ 150 mg/dL) et une maladie cardiovasculaire établie ou un diabète avec au moins un autre facteur de risque cardiovasculaire ».
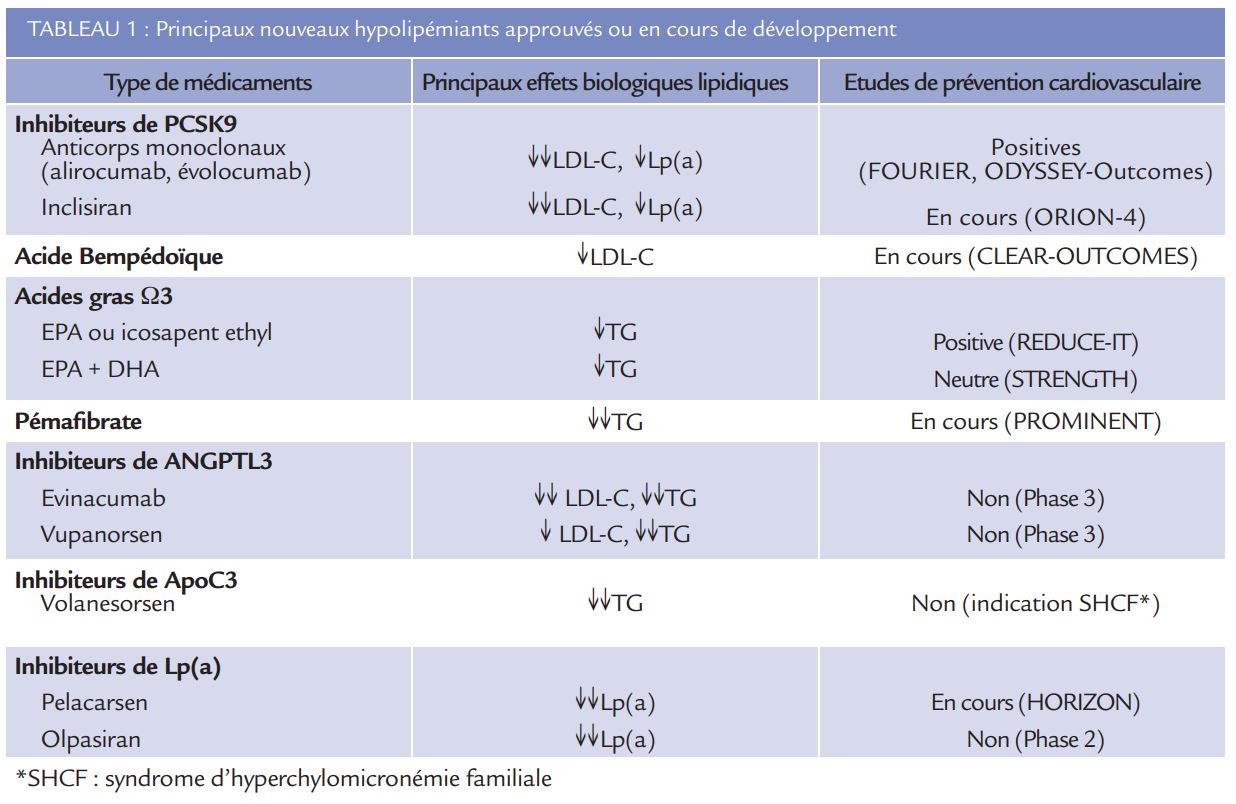
Pémafibrate
Le pémafibrate est un nouvel agent modulateur sélectif de PPARα qui, en association à une statine, aux doses de 0,2 ou 0,4 mg/jour, réduit d’environ 50% le taux de TG avec modification du profil des LDL au profit de LDL de grande taille5 .
Pémafibrate est déjà approuvé dans certains pays comme le Japon pour le traitement des dyslipidémies mixtes. Le bénéfice cardiovasculaire est en cours d’évaluation dans l’étude PROMINENT réalisée chez des patients diabétiques traités par statine et conservant à la fois TG élevés et HDL-cholestérol bas.
Inhibiteurs de ANGPTL3
Outre son effet d’abaissement des LDL, l’évinacumab réduit également les TG chez des patients avec hypertriglycéridémie sévère à haut risque de pancréatite aigüe.
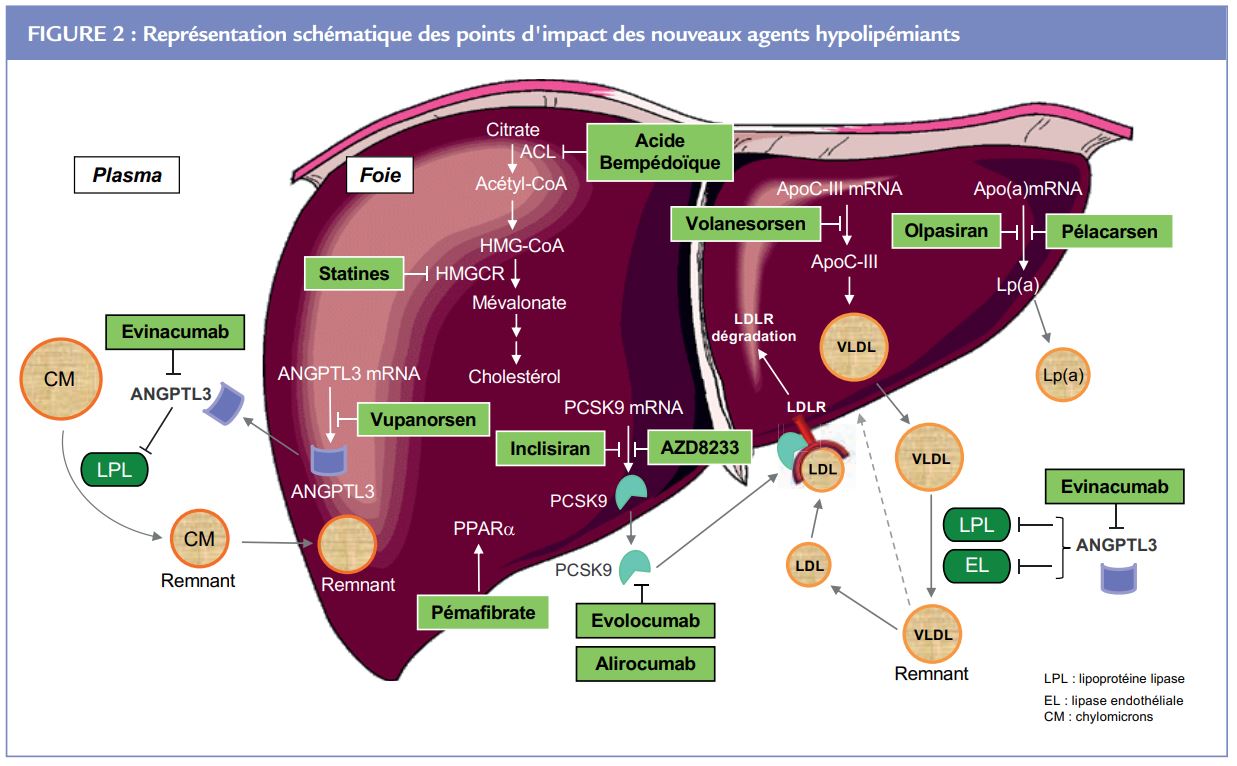
L’inhibition de ANGPTL3 peut être également envisagée avec des oligonucléotides antisens : en phase 2, le vupanorsen, oligonucléotide antisens de seconde génération à forte affinité hépatique, diminue les taux de TG chez des patients avec diabète de type 2 et stéatose hépatique6 . Les effets secondaires les plus fréquents sont des réactions au site d’injection, mais sans cas d’hypoplaquettose.
Inhibiteurs de ApoC3
Une autre approche pour traiter les hypertriglycéridémies sévères est d’inhiber ApoC3. Cette apolipoprotéine est un inhibiteur de la LPL et a aussi été identifiée comme un facteur de risque cardiovasculaire. Jusqu’alors, la stratégie utilisée a été essentiellement l’administration d’oligonucléotides antisens bien que des anticorps monoclonaux semblent donner des résultats prometteurs chez l’animal.
Le 1er oligonucléotide antisens testé est le volanesorsen qui réduit de façon très significative les TG chez des patients avec syndrome d’hyperchylomicronémie familiale7 . Malgré les cas d’hypoplaquettose sévère constatés avec volanesorsen, l’EMA a considéré que le rapport bénéfice/risque était positif et a autorisé volanesorsen pour des patients adultes avec syndrome d’hyperchylomicronémie familiale génétiquement confirmé et à risque élevé de pancréatite, chez qui la réponse au régime alimentaire et aux traitements visant à réduite les TG a été insuffisante et avec antécédents de pancréatite. Ce traitement nécessite une surveillance plaquettaire régulière et la décision de l’instaurer doit être prise en réunion de concertation pluridisciplinaire.
Récemment, une nouvelle formulation de l’antisens dirigé contre ApoC3 et conjugué à la N-acetyl galactosamine (Gal-NAc) a été testée avec confirmation de la réduction des TG et sans effet secondaire majeur.
Nouveaux traitements pour réduire la lipoproteine (a)
La Lp(a) correspond schématiquement à une particule LDL à laquelle est liée de façon covalente l’apolipoprotéine(a). Cette lipoprotéine a des effets à la fois proathérogènes, prothrombotiques et pro inflammatoires. Un taux élevé de Lp(a) est un facteur de risque de maladies cardiovasculaires athéromateuses et également de sténose de la valve aortique, et jusqu’alors aucune thérapeutique ne permet d’agir spécifiquement sur la Lp(a). Des traitements prometteurs sont en développement à savoir des oligonucléotides antisens et des ARN interférents.
Le pelacarsen, antisens conjugué à Gal-NAc pour améliorer la spécificité d’action hépatocytaire, réduit de façon dose dépendante la Lp(a) jusqu’à -80% avec une bonne tolérance en phase 28 . L’essai de prévention
cardiovasculaire Lp(a)-HORIZON va permettre de préciser si l’abaissement pharmacologique de la Lp(a) peut réduire le risque d’évènements cardiovasculaires. Plus récemment un ARN interférent avec liaison directe au niveau du mRNA de l’apo(a) toujours avec conjugaison Gal-NAc a été testé en phase 1 chez 64 patients avec élévation de Lp(a). Une dose unique d’olpasiran a réduit le taux de Lp(a) jusqu’à plus de 90%9 et l’essai de phase 2 est en cours chez des patients en prévention secondaire et avec Lp(a) élevée.
(a). Parmi ces nouvelles approches, nombreuses sont celles fondées sur des données génétiques et biologiques récentes permettant une meilleure compréhension de la régulation de l’ensemble des lipoprotéines athérogènes, avec possibilité d’utiliser une technologie à base d’ARN messager que ce soit des oligonucléotides antisens ou des ARN interférents. Ces nouvelles approches se développent dans 2 directions, la prévention cardiovasculaire et la prévention du risque de pancréatite aigüe, avec possibilité de traiter des formes génétiques très sévères de dyslipidémies comme les hypercholestérolémies familiales homozygotes et les syndromes d’hyperchylomicronémie familiale.
Conclusion
De nombreuses nouvelles approches thérapeutiques sont en développement pour tenter de réduire le risque cardiovasculaire résiduel lié à un excès de lipoprotéines athérogènes LDL, lipoprotéines riches en TG et lipoprotéine (a). Parmi ces nouvelles approches, nombreuses sont celles fondées sur des données génétiques et biologiques récentes permettant une meilleure compréhension de la régulation de l’ensemble des lipoprotéines athérogènes, avec possibilité d’utiliser une technologie à base d’ARN messager que ce soit des oligonucléotides antisens ou des ARN interférents. Ces nouvelles approches se développent dans 2 directions, la prévention cardiovasculaire et la prévention du risque de pancréatite aigüe, avec possibilité de traiter des formes génétiques très sévères de dyslipidémies comme les hypercholestérolémies familiales homozygotes et les syndromes d’hyperchylomicronémie familiale.
Michel Farnier Equipe PEC2, EA 7460, Université de Bourgogne Franche-Comté, Dijon
Le docteur Michel Farnier déclare avoir reçu des honoraires en tant qu’investigateur, expert scientifique et/ou conférencier de la part des firmes suivantes : Abbott, Amarin, Amgen, Astra-Zeneca, Austell, Kowa, Merck and Co, Organon, Recordati, Sanofi /Regeneron, Servier, SMB et Viatris.
RÉFÉRENCES
- Wright RS, Ray KK, Raal FJ, et al. ; ORION Phase III Investigators. Pooled patient-level analysis of inclisiran trials in patients with familial hypercholesterolemia or atherosclerosis. J Am Coll Cardiol 2021; 77: 1182-1193.
- Banach M, Duell PB, Gotto AM Jr, et al. Association of bempedoic acid administration with atherogenic lipid levels in phase 3 randomized clinical trials of patients with hypercholesterolemia. JAMA Cardiol 2020;5: 1-12.
- Raal FJ, Rosenson RS, Reeskamp LF, et al. ; ELIPSE HoFH Investigators. Evinacumab for homozygous familial hypercholesterolemia. N Engl J Med 2020; 383: 711-720.
- Bhatt DL, Steg PG, Miller M, et al. ; REDUCE-IT Investigators. Cardiovascular risk reduction with icosapent ethyl for hypertriglyceridemia. N Engl J Med 2019 ; 380: 11-22.
- Arai H, Yamashita S, Yokote K, Araki E, Suganami H, Ishibashi S; K-877 Study Group. Effi cacy and safety of K-877, a novel selective peroxisome proliferator-activated receptor � modulator (SPPARM�), in combination with statin treatment: Two randomised, double-blind, placebo-controlled clinical trials in patients with dyslipidaemia. Atherosclerosis 2017; 261: 144-152.
- Gaudet D, Karwatowska-Prokopczuk E, Baum SJ, et al. ; Vupanorsen Study Investigators. Vupanorsen, an N-acetyl galactosamine-conjugated antisense drug to ANGPTL3 mRNA, lowers triglycerides and atherogenic lipoproteins in patients with diabetes, hepatic steatosis, and hypertriglyceridaemia. Eur Heart J 2020 ; 41 : 3936-3945.
- Witztum JL, Gaudet D, Freedman SD, et al. Volanesorsen and triglyceride levels in familial chylomicronemia syndrome.N Engl J Med 2019; 381: 531-542.
- Tsimikas S, Karwatowska-Prokopczuk E, Gouni-Berthold I, et al. ; AKCEA-APO(a)-LRx Study Investigators. Lipoprotein(a) reduction in persons with cardiovascular disease. N Engl J Med 2020; 382: 244-255.
- Koren M, Moriarty PM, Neutel J, et al. Safety, Tolerability and Efficacy of Single-dose Amg 890, a Novel Sirna Targeting Lp(a), in Healthy Subjects and Subjects With Elevated Lp(a). Circulation 2020 ; 142 : A 13951
