
Stéatose hépatique métabolique (NAFLD) : une comorbidité fréquente chez les patients
La NAFLD ou stéatose hépatique métabolique atteint environ un adulte français sur cinq. Elle est le plus souvent asymptomatique et d’évolution lente, restant sous-diagnostiquée. Elle doit être suspectée devant des perturbations inexpliquées du bilan hépatique (élévation des transaminases et/ou des gamma-GT), et/ou une hyperferritinémie mais elle est souvent découverte de façon fortuite devant la présence d’une stéatose hépatique à l’échographie abdominale. Elle doit être recherchée systématiquement en cas de facteurs de risque métabolique. Après le diagnostic de NAFLD, l’identification du stade de fibrose hépatique par des tests non-invasifs (tests sanguins ou mesure de l’élasticité hépatique) est fondamentale. En cas de fibrose avancée, le patient nécessite un suivi spécialisé par un hépatologue.
Introduction
Le syndrome métabolique est reconnu comme facteur de risque cardiovasculaire depuis la fin des années 901 et son incidence est en augmentation constante en raison du style de vie moderne favorisant la sédentarité et l’obésité2 . L’allongement de l’espérance de vie est également responsable de l’augmentation du diabète de type 2, de l’hypertension artérielle et/ou des dyslipidémies. Cependant, la stéatose hépatique en lien avec le syndrome métabolique (NAFLD, nonalcoholic fatty liver disease), malgré une prévalence élevée dans la population adulte (25% mais pouvant atteindre 46% en fonction de l’âge, du sexe et de l’origine ethnique), n’est reconnue que depuis une dizaine d’années3 . La NAFLD, peu connue du grand public et d’autres spécialités médicales en dehors de l’hépatologie, est désormais une « comorbidité » courante observée par les endocrinologues et les cardiologues dans la pratique clinique. L’objectif de cette revue est de faire le point sur la NAFLD et sur le rôle du cardiologue dans le dépistage et la prise en charge initiale de cette maladie.
Quand suspecter une NAFLD ?
Facteurs de risque
En pratique, tous les patients présentant des facteurs de risque métabolique (obésité, diabète de type 2, hypertension artérielle et/ou dyslipidémie) devraient être dépistés pour la NAFLD, en particulier les patients de plus de 50 ans. Dans une étude réalisée chez 922 sujets de la population générale à Hong Kong4 , chez qui était recherchée systématiquement une stéatose par IRM, celle-ci était retrouvée chez moins de 10% des sujets de moins de 50 ans, n’ayant aucun facteur de risque métabolique. A l’inverse, sa fréquence augmentait de façon linéaire avec le nombre de facteurs de risque pour atteindre 90% chez les sujets âgés de plus de 50 ans, obèses, diabétiques de type 2, hypertendus et dyslipidémiques. Les patients atteints de diabète de type 2 ont une prévalence élevée de NAFLD (40 à 70%)5 et un risque deux fois plus élevé de développer une maladie sévère (cirrhose et carcinome hépatocellulaire)6 .
Enfin, en cas de suspicion de NAFLD, d’autres causes de maladie hépatique (alcool, virus de l’hépatite B ou C) doivent être recherchées car le patient peut présenter une maladie hépatique d’origine mixte. Les causes secondaires de stéatose doivent être également écartées : certains médicaments prescrits pour une longue durée (corticoïdes, amiodarone, inhibiteurs calciques, cyclines, estrogènes et tamoxifène), la nutrition parentérale prolongée et un bypass jéjunoiléal, ainsi que les patients ayant un antécédent de chirurgie bariatrique.
Découverte fortuite d’une stéatose hépatique
La stéatose hépatique est le plus souvent découverte de façon fortuite à l’imagerie. L’échographie conventionnelle est la technique d’imagerie la plus fréquemment utilisée pour le diagnostic, du fait de sa large disponibilité, de son innocuité et de son faible coût. Le signe échographique typique de la stéatose est l’hyperéchogénicité du parenchyme hépatique par rapport au parenchyme rénal droit7 . Dans une méta-analyse (n=34 études, 2 815 patients ayant une maladie du foie suspectée ou connue), prenant la biopsie hépatique comme référence, la sensibilité et la spécificité de l’échographie pour la détection d’une stéatose modérée à sévère (> 33%), étaient respectivement de 85% et 93%8 . Cependant, en pratique l’échographie présente plusieurs limites : elle est opérateur-dépendante, elle ne permet la détection d’une stéatose que lorsque celle-ci est au moins supérieure à 15%, enfin ses performances sont moins bonnes chez les patients obèses7 .
D’autres techniques d’imagerie peuvent également être utilisées pour diagnostiquer la présence d’une stéatose9 . Le CAP (paramètre d’atténuation contrôlée), mesure le degré d’atténuation échographique de la stéatose, en même temps, que l’élasticité hépatique par Fibroscan® (Echosens, Paris, France).
Ses résultats sont exprimés en décibels par mètre (dB/m) avec des valeurs comprises entre 100 et 400 dB/m. Dans une méta-analyse récente10, le CAP avait une bonne performance (AUROC : 0,82) pour la détection de la stéatose (≥ 5%) chez les patients atteints de NAFLD (n=1 277). C’est donc une technique permettant une détection rapide et standardisée de la stéatose. Alors qu’il n’existe pas de seuils consensuels, des valeurs de CAP > 275 dB/m ont une sensibilité et une valeur prédictive élevées (> 90%) pour la détection d’une stéatose ≥ 5%11. L’IRM-PDFF (Magnetic resonance proton density fat fraction) est une technique d‘imagerie précise et reproductible avec d’excellentes performances pour détecter et quantifier la stéatose hépatique. Cependant, son coût et sa disponibilité restreinte, limitent son utilisation en pratique clinique courante9 .
Toutes ces techniques d’imagerie peuvent donc faire suspecter la présence d’une stéatose, mais également confirmer le diagnostic de NAFLD11.
Anomalies du bilan hépatique
Les anomalies du bilan hépatique sont assez peu spécifiques, consistant en une élévation des transaminases (ASAT et ALAT), le plus souvent modérée (< 5 fois la normale) et associée ou non à une élévation des gamma-GT, également modérée (< 5 fois la normale). La présence de ces anomalies impose d’éliminer les autres causes de maladies chroniques du foie : maladie alcoolique, hépatites chroniques virales B et C, hémochromatose, etc.
Du fait de sa prévalence élevée, la NAFLD peut coexister avec d’autres maladies chroniques du foie. Dans ce cas, la NAFLD peut agir comme cofacteur aggravant qui favorise l’évolution vers une forme plus rapide et plus sévère d’hépatopathie chronique12.
En résumé, devant une élévation persistante et inexpliquée des enzymes hépatiques, il est recommandé de rechercher systématiquement une NAFLD3 .
Hyperferritinémie métabolique
La NAFLD est la principale cause d’hyperferritinémie et un motif fréquent d’envoi au spécialiste pour suspicion d’hémochromatose. Cependant contrairement à ce qui est observé dans l’hémochromatose génétique, la ferritinémie est le plus souvent inférieure à 1 000 µg/l avec un coefficient de saturation de la transferrine normal, c’est-à-dire inférieur à 45 %13. Les autres causes d’hyperferritinémie secondaires doivent bien sûr être éliminées : alcoolisme chronique, syndrome inflammatoire, hyperthyroïdie, cancers et hémopathies.
Cirrhose d’étiologie indéterminée
Une NAFLD est retrouvée chez 30 à 75 % des patients consultant pour une cirrhose d’origine indéterminée ou cryptogénique14. Au stade de cirrhose, les critères histologiques classiques de la NAFLD, notamment la stéatose et la ballonisation des hépatocytes, sont souvent absents. Le diagnostic repose alors sur l’exposition présente ou passée aux facteurs de risque métabolique.
Comment diagnostiquer : NAFLD ou NASH ?
Après l’élimination d’autres maladies hépatiques chroniques, le diagnostic de NAFLD sera facilement posé par la présence d’une stéatose hépatique à l’imagerie : CAP > 275 dB/m (ou d’autres tests hépatiques noninvasifs), échographie avec un foie hyperéchogène de taille normale ou augmentée, et/ou IRM-PDFF avec signes de surcharge stéatosique (> 5,6%)11.
En revanche, le diagnostic de NASH est plus compliqué car les transaminases ne permettent pas de confirmer la présence d’une inflammation hépatique significative et donc du diagnostic de NASH12. De nombreux scores ont été proposés pour le diagnostic non-invasif de la NASH, mais ne permettent de différencier la NASH de la stéatose simple (NAFLD)15. Dans ce contexte, la biopsie hépatique reste l’examen de référence pour le diagnostic de la NASH11. Cependant, compte tenu du fait qu’aucun traitement pour la NASH n’est actuellement disponible, la réalisation d’une biopsie hépatique pour prouver ce diagnostic n’est pas nécessaire, sauf en cas de projet d’inclusion dans un essai thérapeutique.
Comment évaluer la sévérité ?
C’est la fibrose hépatique au stade avancé (stade de fibrose avancée, F3 ou cirrhose, F4), qui fait toute la sévérité de la NAFLD, car elle est corrélée non seulement aux risques de complications hépatiques mais également à la mortalité hépatique et à la mortalité globale (cardiovasculaire notamment)16. Le défi en pratique est donc d’identifier parmi les nombreux patients atteints de NAFLD, la minorité qui a une fibrose avancée. La méthode de référence pour la quantification de la fibrose est l’examen histologique du foie3 . Cependant compte tenu du nombre très important de patients concernés (un Français sur 5 environ), du caractère invasif de la biopsie et du fait qu’elle ne peut être pratiquée que dans un nombre limité de centres experts, la biopsie ne peut pas être utilisée en première ligne pour l’évaluation du stade de fibrose et des méthodes non invasives sont à privilégier.
Les méthodes non invasives reposent sur deux approches différentes mais complémentaires : la mesure de concentrations plasmatiques ou sériques de marqueurs de fibrose, ou la mesure de l’élasticité hépatique à l’aide de techniques d’élastographie ultrasonore9 . Elles ont été initialement validées chez les patients atteints d’hépatites chroniques virales B et C et sont désormais largement utilisées chez les patients atteints de NAFLD et font l’objet de recommandations internationales11.
Tests sanguins
Les tests sanguins non brevetés (gratuits) les mieux validés dans la littérature sont le FIB-4 (âge, ASAT, ALAT, et plaquettes) et le NAFLD Fibrosis Score (NFS) (âge, index de masse corporelle, hyperglycémie/ diabète, ASAT, ALAT, plaquettes, et albumine). Ces tests sont surtout performants pour éliminer une fibrose avancée (valeur prédictive négative de plus de 90 % pour les seuils suivants : FIB4 < 1,30 ; NFS < -1,455)17. En revanche, leurs performances sont moins bonnes pour affirmer le diagnostic de fibrose avancée (valeur prédictive positive de moins de 70 % pour les seuils suivants : FIB4 > 2,67 ; NFS > 0,676). Entre les deux seuils, il existe une zone grise (environ 30 % des patients) pour laquelle le diagnostic est indéterminé . Malgré leurs performances similaires, le NFS nécessite le dosage de la glycémie et de l’albumine, ce qui en limite l’accessibilité et augmente son coût comparativement au FIB-4. Celui-ci est le plus facile car il associe des variables disponibles en routine et est souvent calculé automatiquement par les laboratoires. Les tests sanguins brevetés (payants) les mieux validés sont le score ELFTM, le FibrotestTM, et le FibroMètreTM. Ces tests, ont en général, des performances un peu meilleures que celles du FIB-4 et de NFS. Toutefois, leur faible disponibilité et leur coût limitent leur utilisation en pratique courante11.
Mesure de l’élasticité hépatique
Le FibroScan® a été le pionnier des appareils de mesure de l’élasticité hépatique dans les années 2000 18. Il s’agit d’un examen indolore, rapide, sans aucun risque, avec des résultats immédiats et pouvant être réalisés en consultation. L’appareil génère par vibration une onde mécanique de faible amplitude à partir de la paroi thoracique en regard du foie19. La vitesse de propagation de celle-ci est alors mesurée : plus le foie est dur (plus la fibrose est sévère), plus l’onde va vite (plus l’élasticité est élevée). Il faut effectuer dix mesures valides et le résultat est considéré comme fiable si le ratio de la médiane de ces dix acquisitions sur l’interquartile range (IQR, reflétant la variabilité des mesures) est inférieur à 30%. Chez les patients ayant un IMC > 30, la sonde XL est recommandée pour minimiser le taux d’échec. Les valeurs d’élasticité sont comprises entre 2,5 et 75 kPa, avec une normale aux alentours de 5 kPa. Les performances du FibroScan sont excellentes pour le diagnostic de fibrose avancée avec des AUROCs > 0,917. Des valeurs inférieures à 8 kPa ont une excellente valeur prédictive négative (96 %) pour exclure le diagnostic de fibrose avancée20. Enfin, plusieurs facteurs peuvent entraîner des faux positifs : inflammation hépatique, stéatose, cholestase, insuffisance cardiaque, jeûne inférieur à 2 heures. Ces facteurs doivent donc être pris en compte dans l’interprétation des résultats, surtout l’insuffisance cardiaque qui provoque une congestion hépatique et surestime les valeurs d’élasticité.
Des modules d’élastométrie sont désormais intégrés dans la plupart des appareils d’échographie actuellement commercialisés. Leurs performances restent beaucoup moins bien évaluées que celles du FibroScan mais semblent similaires. Cependant en pratique, leur disponibilité reste le plus souvent limitée aux services de radiologie et d’hépatologie. Enfin, l’élastographie par résonance magnétique est une technique prometteuse mais pour l’instant insuffisamment validée, peu disponible et trop coûteuse pour pouvoir être utilisée en pratique courante11.
Utilisation en pratique
L’utilisation séquentielle de deux tests (test sanguin et FibroScan) est la stratégie de choix (Figure 1)15. Ainsi il est recommandé de commencer par un test sanguin non breveté (FIB-4) permettant d’éliminer la présence d’une fibrose avancée (< 1,3) avec une grande sensibilité chez plus de 70% des patients atteints de NAFLD vus en médecine générale. Les 30% restants devraient être adressés à un spécialiste pour un deuxième examen plus spécifique (FibroScan). Seuls les patients ayant des valeurs d’élasticité > à 8 kPa, devraient être considérés pour une PBH, dont l’indication sera décidée en fonction du contexte clinique et des implications pour la suite de la prise en charge.
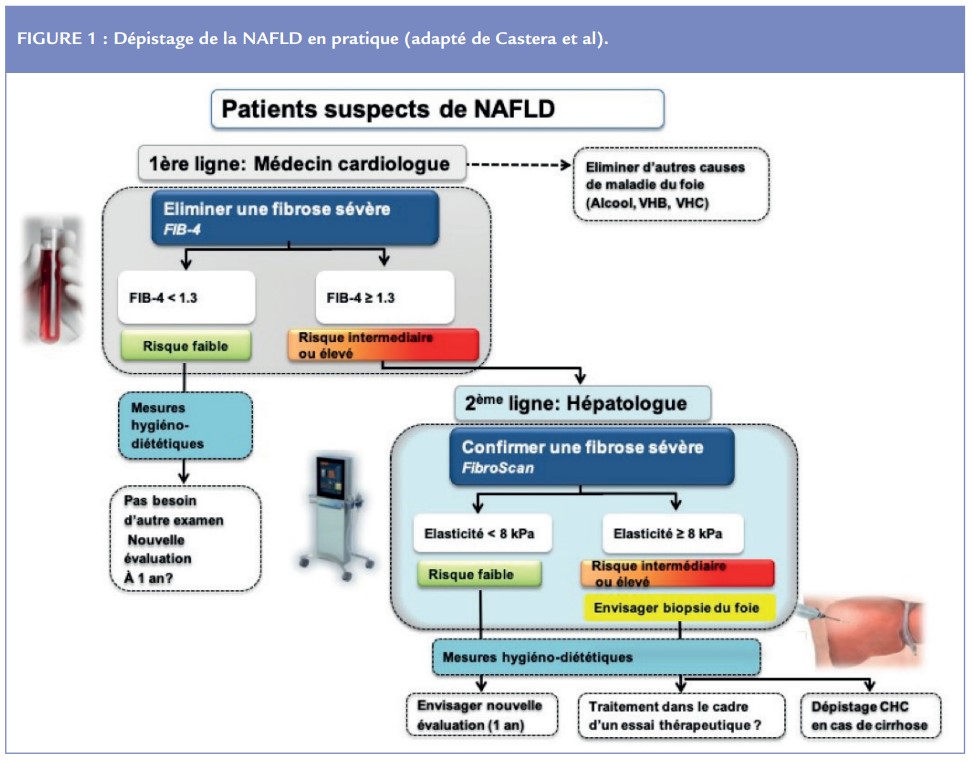
Prise en charge initiale par le cardiologue
La première étape dans la prise en charge du malade atteint de cardiopathie présentant un syndrome métabolique est de penser à dépister la NAFLD.
En cas de confirmation du diagnostic, indépendant du degré d’inflammation et de fibrose hépatique, y compris chez des patients avec une forte suspicion de cirrhose, les recommandations3 sont les suivantes :
1) Un contrôle adéquat de tous les éléments du syndrome métabolique, avec un ajustement du traitement médical si nécessaire pour atteindre les objectifs thérapeutiques souhaités.
2) Une perte de poids pour les patients en surpoids ou ayant une obésité. Une étude clinique prospective a démontré qu’une perte de plus de 10% du poids initial était associée à une amélioration significative de la maladie hépatique21.
3) Une modification du régime alimentaire, souvent vers la diète méditerranéenne, ce qui permet d’avoir une perte de poids et un meilleur contrôle glycémique et lipidique22.
4) Une activité physique régulière modérée à vigoureuse, aérobie et/ou anaérobie, idéalement plus de 3 fois par semaine pendant au moins 30 minutes23.
5) Un sevrage tabagique si possible.
6) Une réduction de la consommation d’alcool avec 20g d’alcool par jour maximum, 5 jours par semaine, selon les recommandations de l’OMS24.
Pour les patients présentant une forte suspicion de fibrose avancée selon les méthodes non-invasives, une demande d’avis spécialisé est fortement recommandée. Le patient aura une évaluation complète et pourra bénéficier de l’accès à des traitements pharmacologiques dans le cadre d’essais thérapeutiques en cas de NASH d’évolution fibrosante. Le dialogue entre hépatologue et cardiologue est capital pour la réussite d’une prise en charge multidisciplinaire, sachant que la principale difficulté est de maintenir les bénéfices obtenus sur une durée prolongée.
RÉFÉRENCES
1. Howard WJ. Diagnosis and Management of the Metabolic Syndrome: An American Heart Association/National Heart, Lung, and Blood Institute Scientifi c Statement. Circulation. 2005;(112):2735-52.
2. Moore JX, Chaudhary N, Akinyemiju T. Metabolic Syndrome Prevalence by Race/Ethnicity and Sex in the United States, National Health and Nutrition Examination Survey, 1988–2012. Prev Chronic Dis.
2017;14:160287.
3. EASL–EASD–EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol. 2016;64(6):1388-402.
4. Wong V, Chu W, Wong G. Prevalence of non-alcoholic fatty liver disease and advanced fi brosis in hong kong chinese: A population study using proton-magnetic resonance spectroscopy and transient
elastography. Gut. 2012;61:409-15.
5. Younossi ZM, Golabi P, de Avila L, Paik JM, Srishord M, Fukui N, et al. The global epidemiology of NAFLD and NASH in patients with type 2 diabetes: A systematic review and meta-analysis. J Hepatol.
2019;71(4):793-801.
6. Jarvis H, Craig D, Barker R, Spiers G, Stow D, Anstee QM, et al. Metabolic risk factors and incident advanced liver disease in non-alcoholic fatty liver disease (NAFLD): A systematic review and meta-analysis
of population-based observational studies. Singal A, éditeur. PLOS Med. 2020;17(4):e1003100.
7. Bril F, Ortiz-Lopez C, Lomonaco R, Orsak B, Freckleton M, Chintapalli K, et al. Clinical value of liver ultrasound for the diagnosis of nonalcoholic fatty liver disease in overweight and obese patients. Liver
Int. 2015;35(9):2139-46.
8. Hernaez R, Lazo M, Bonekamp S, Kamel I, Brancati FL, Guallar E, et al. Diagnostic accuracy and reliability of ultrasonography for the detection of fatty liver: A meta-analysis. Hepatology. 2011;54(3):1082-90.
9. Stern C, Castera L. Non-invasive diagnosis of hepatic steatosis. Hepatol Int. 2017;11(1):70-8.
10. Petroff D, Blank V, Newsome PN, Shalimar, Voican CS, Thiele M, et al. Assessment of hepatic steatosis by controlled attenuation parameter using the M and XL probes: an individual patient data metaanalysis. Lancet Gastroenterol Hepatol. 2021;6(3):185-98.
11. Berzigotti A, Tsochatzis E, Boursier J, Castera L, Cazzagon N, Friedrich-Rust M, et al. EASL Clinical Practice Guidelines on non-invasive tests for evaluation of liver disease severity and prognosis – 2021
update. J Hepatol. 2021;75(3):659-89.
12. Powell EE, Wong VWS, Rinella M. Non-alcoholic fatty liver disease. The Lancet. 2021;397(10290):2212-24.
13. Moirand R, Mortaji AM, Loréal O, Paillard F, Brissot P, Deugnier Y. A new syndrome of liver iron overload with normal transferrin saturation. The Lancet. 1997;349(9045):95-7.
14. Younossi Z, Stepanova M, Sanyal AJ, Harrison SA, Ratziu V, Abdelmalek MF, et al. The conundrum of cryptogenic cirrhosis: Adverse outcomes without treatment options. J Hepatol. 2018;69(6):1365-70.
15. Castera L, Friedrich-Rust M, Loomba R. Noninvasive Assessment of Liver Disease in Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology. 2019;156(5):1264-1281.e4.
16. Dulai PS, Singh S, Patel J, Soni M, Prokop LJ, Younossi Z, et al. Increased risk of mortality by fi brosis stage in nonalcoholic fatty liver disease: Systematic review and meta-analysis: Dulai et al. Hepatology.
2017;65(5):1557-65.
17. Xiao G, Zhu S, Xiao X, Yan L, Yang J, Wu G. Comparison of laboratory tests, ultrasound, or magnetic resonance elastography to detect fi brosis in patients with nonalcoholic fatty liver disease: A meta analysis.
Hepatology. 2017;66(5):1486-501.
18. Sandrin L, Fourquet B, Hasquenoph JM, Yon S, Fournier C, Mal F, et al. Transient elastography: a new noninvasive method for assessment of hepatic fi brosis. Ultrasound Med Biol. 2003;29(12):1705-13.
19. Castera L, Forns X, Alberti A. Non-invasive evaluation of liver fibrosis using transient elastography. J Hepatol. 2008;48(5):835-47.
20. Eddowes PJ, Sasso M, Allison M, Tsochatzis E, Anstee QM, Sheridan D, et al. Accuracy of FibroScan Controlled Attenuation Parameter and Liver Stiffness Measurement in Assessing Steatosis and Fibrosis
in Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology. 2019;156(6):1717-30.
21. Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L, Torres-Gonzalez A, Gra-Oramas B, Gonzalez-Fabian L, et al. Weight Loss Through Lifestyle Modifi cation Signifi cantly Reduces Features of Nonalcoholic
Steatohepatitis. Gastroenterology. 2015;149(2):367-378.e5.
22. Katsagoni CN, Papatheodoridis GV, Ioannidou P, Deutsch M, Alexopoulou A, Papadopoulos N, et al. Improvements in clinical characteristics of patients with non-alcoholic fatty liver disease, after an
intervention based on the Mediterranean lifestyle: a randomised controlled clinical trial. Br J Nutr. 2018;120(2):164-75.
23. Hashida R, Kawaguchi T, Bekki M, Omoto M, Matsuse H, Nago T, et al. Aerobic vs. resistance exercise in non-alcoholic fatty liver disease: A systematic review. J Hepatol. 2017;66(1):142-52.
24. Thursz M, Gual A, Lackner C, Mathurin P, Moreno C, Spahr L, et al. EASL Clinical Practice Guidelines: Management of alcohol-related liver disease. J Hepatol. 2018;69(1):154-81.
Christiane Stern, Laurent Castera,
Hôpital Beaujon, AP-HP, Clichy, Université de Paris, INSERM UMR 1149, RHU QUID-NASH
